- in Yoga
Главное меню:
- Новости
- Разделитель 6
- О нас
- Разделитель 5
- Статьи
- Разделитель 3
- Асана
- Разделитель 8
- Магазин
- Разделитель 1
- Библиотека
- Разделитель 4
- Рецепты
- Разделитель 9
- Фитотерапия
Статьи
Содержание:
Глава 1. Общая информация о жирах
- Разновидности жиров.
- Что такое Омега-3, Омега-6 и Омега-9
- Откуда в льняном масле а-линоленовая кислота
- Откуда в рыбе ЭПК и ДГК
- Трансжиры - внимание! Опасно!
- Животный жир
- Молочный жир
- Масла
- Температура дымления масла
- Орехи
- Какао-бобы
- Протеин
- Жир+углеводы или жир+белок?
- Углеводы, которые создают жир
- Немного о фруктозе
- Основной обмен
- АТФ
- Метаболические пути
- Гликолиз
- Цикл Кребса
- Окислительное фосфорилирование
- Метаболизм углеводов
- Метаболизм жиров
- Метаболизм белков и аминокислот
- Образование в печени ацетоуксусной кислоты
- Кетоз при голодании и привыкание к жирной пище
- Незаменимые компоненты диеты
- Переваривание и всасывание
- Влияние гормонов
- Адреналин
- Влияние на сердце
- Холестерин
- Липопротеины - что это?
- Висцеральный жир хуже, чем подкожный
- Что заставляет жир накапливаться в теле человека
- Целлюлит
- Инсулино-резистентность
- Йога, активная динамика
- Прогибы и позы лежа на животе
- Активные дыхательные практики
- Уддияна-бандха и брюшные манипуляции
- Спокойный ум
ГЛАВА 3. ВНУТРИ НАШЕГО ТЕЛА
Если эта глава покажется сложной, можно пропустить её. Но мне было интересно разобраться чуть глубже… Начнем с метаболизма!
В каждый момент в организме происходят тысячи химических реакций, этот скоординированный процесс химических изменений называется метаболизмом (от греч. «изменение»). Метаболизм включает процессы синтеза и распада органических молекул, необходимые для поддержания структуры и функции клетки, и освобождение химической энергии, используемой для осуществления клеточных функций. Синтез органических молекул клеткой называется анаболизм, а их распад – катаболизм.
Органические молекулы организма претерпевают постоянную трансформацию: одни молекулы распадаются, в то время как другие молекулы того же соединения синтезируются. Химически ни один из организмов не является тем же самым в полдень и 8 часов утра, поскольку даже за этот короткий период бОльшая часть структур организма прекращает свое существование и заменяется вновь синтезированными молекулами. У взрослых организм находится в стационарном состоянии, когда скорости катаболизма и анаболизма равны.
Энергия, которая освобождается в виде тепла, – это энергия увеличенного движения молекул, измеряемая в калориях. Одна калория (1 кал) – это количество тепла, необходимое для повышения температуры 1 г воды на 1 градус С. 1 ккал = 1000 кал.
ОСНОВНОЙ ОБМЕН
Под основным обменом принято понимать минимальный уровень энергозатрат для поддержания жизнедеятельности организма, при условиях относительно полного физического, эмоционального и психического покоя.
И в этом состоянии тело как система должно поддерживать:
• функционирование нервной системы
• непрерывный синтез веществ
• работу ионных насосов
• температуру
• деятельность дыхательной мускулатуры
• функции гладких мышц
• работу сердца и почек
Энергозатраты организма возрастают при:
• физической и умственной работе
• психическом напряжении
• переваривании пищи
• понижении температуры окружающей среды
Для того, чтобы замерить уровень энергозатрат в среднем, применяются особые условия этого замера: утром, натощак, в положении лежа, при расслаблении мышц, в состоянии бодрствования и температурного комфорта.
Полученные величины основного обмена характеризуют исходный «базальный» уровень энергозатрат организма. Для взрослого человека – это примерно 1 ккал/кг/ч. Следовательно, в сутки, для мужчины массой 70 кг – это около 1700 ккал, а для женщины массой в 50 кг – это около 1200 ккал.
Интенсивность основного обмена тесно связана с размерами поверхности тела, что обусловлено зависимостью отдачи тепла.
Также, имеет место влияние возраста. Так, например, преобладание в детском возрасте процессов анаболизма в обмене веществ, обуславливает более высокие значения величин основного обмена. И, наоборот, пожилой возраст является временем замедления основного обмена.
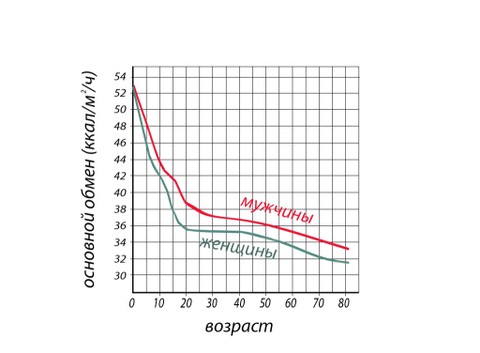
Причинами отклонения величин основного обмена в связи с возрастом могут быть относительное уменьшение мышечной массы и замещение мышечной ткани жировой, обладающей меньшей интенсивностью метаболических реакций.
Другие факторы, которые влияют на основной обмен:
• гормоны щитовидной железы увеличивают интенсивность метаболических процессов
• мужские половые гормоны увеличивают интенсивность метаболизма
• гормон роста увеличивает интенсивность метаболизма
• высокая температура тела повышает интенсивность метаболизма
• сон снижает интенсивность метаболизма
• пониженное питание снижает интенсивность обменных процессов
Также, среди прочих факторов, не последнее место, с точки зрения влияния на основной обмен, занимает физическая активность.
Даже в условиях покоя, на долю скелетных мышц приходится 20-30% величины основного обмена!
Теперь, мы плавно подошли к тому, что нужно телу для осуществления любой физической активности. Телу нужно «топливо».
АТФ
В клетках всех организмов, от бактерий до человека первичной молекулой, к которой переносится энергия, образующаяся в результате распада соединений, используемых в качестве «топлива» (углеводы, жиры и белки), и которая затем доставляет эту энергию к процессам, обеспечивающим функцию клеток, является нуклеотид аденозинтрифосфат (АТФ).
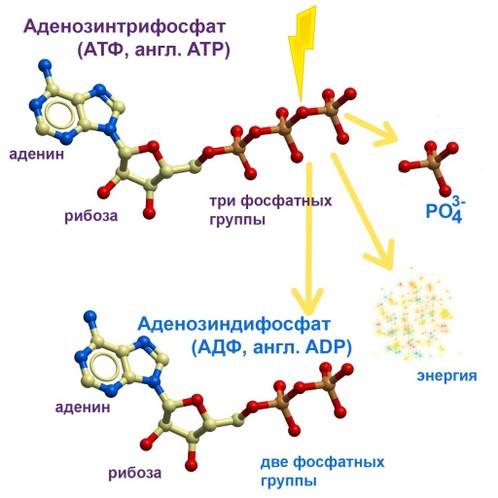
Когда в присутствии кислорода в клетке распадается 1 моль глюкозы, превращаясь в двуокись углерода и воду, освобождается 686 ккал энергии. Часть этой энергии преобразуется в тепло (примерно 60%), однако клетка не может использовать тепловую энергию для осуществления своих функций. Оставшаяся энергия трансформируется в молекулу АТФ (40%).
Следует заметить, что клетка использует АТФ не для хранения энергии, а для её переноса. АТФ – это молекула, которая переносит относительно небольшое количество энергии от молекул «топлива» к клеточным процессам, нуждающимся в ней.
Её часто называют энергетической валютой клетки. Можно провести следующую аналогию. Если количество энергии, которое можно использовать и которое освобождается при катаболизме одной молекулы глюкозы, эквивалентно банкноте в 10 долл., то энергия, освобождаемая при гидролизе одной молекулы АТФ, будет стоить примерно четверть доллара (25 центов). Клеточные системы, нуждающиеся в энергии, принимают только монеты достоинством 25 центов – они не принимают 10-долларовые банкноты. Трансформация энергии в АТФ – это способ, с помощью которого клетка разменивает банкноты.
Энергия в клетке постоянно совершает круговорот, проходя через АТФ. Типичная молекула АТФ может существовать лишь несколько секунд до того, как распадется на АДФ и Pi с освобождением энергии, используемой для обеспечения клеточных функций. Столь же быстро продукты гидролиза АТФ (АДФ и Pi ) вновь превращаются в АТФ за счет сопряжения реакций, которые освобождают энергию в процессе катаболизма углеводов, жиров и белков.
Общее количество молекул АТФ в организме достаточно для поддержания функций в состоянии покоя всего лишь в течение примерно 90 секунд. Таким образом, энергия должна постоянно превращаться, переходя от молекул топлива к АТФ.
МЕТАБОЛИЧЕСКИЕ ПУТИ
Для превращения в АТФ энергии, которая освобождается при распаде молекул «топлива», клетка использует три различных, но взаимосвязанных пути. Это гликолиз, цикл Кребса и окислительное фосфорилирование.
Необходимо отметить несколько фактов:
1. в процесс гликолиза включаются только углеводы
2. все три категории питательных веществ: углеводы, жиры и белки – вносят свой вклад в производство АТФ через цикл Кребса и окислительное фосфорилирование
3. в этих процессах существенную роль играют митохондрии
4. гликолиз может происходить как в отсутствии, так и в присутствии кислорода, цикл Кребса и окислительное фосфорилирование нуждаются в нем
ТРАНСПОРТ ЭНЕРГИИ В КЛЕТКЕ
ГЛИКОЛИЗ
Гликолиз (от греч. гликос – сахар, лизис – распад) является метаболическим путем, в котором происходит частичный катаболизм углеводов, прежде всего глюкозы. Он состоит из 10 метаболических реакций, ни в одной из которых не используется молекулярный кислород, и происходит в цитозоле.
В результате этих 10 реакций шестиуглеродная молекула глюкозы превращается в две трехуглеродные молекулы пирувата (ионизированной формы пировиноградной кислоты). В результате гликолиза производится две молекулы АТФ и четыре атома водорода.
Конечный продукт гликолиза, пируват, может превращаться в одном из двух направлений в зависимости от доступности молекулярного кислорода, который сам по себе не используется ни в одной из реакций гликолиза. Если присутствует кислород (то есть существуют аэробные условия), то пируват может входить в цикл Кребса и распадаться до двуокиси углерода. В отсутствие кислорода (анаэробные условия) пируват превращается в лактат (ионизированная форма молочной кислоты) с помощью единственной ферментативной реакции.
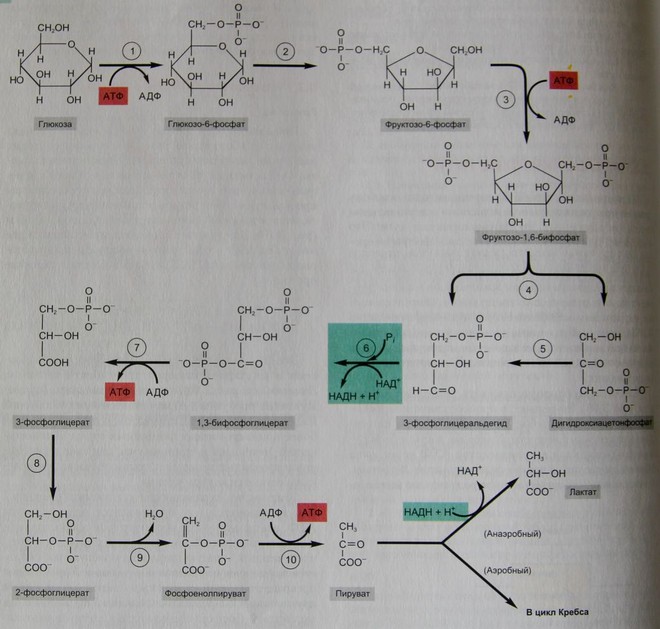
Рис. Гликолиз
В большей части клеток количество АТФ, которое образуется при гликолизе из одной молекулы глюкозы, значительно меньше, чем образуемое в аэробных условиях в цикле Кребса и окислительном фосфорилировании. Однако есть ситуации, в которых гликолиз поставляет большую часть или даже всю АТФ в клетке. Например, эритроциты содержат ферменты гликолиза, но не имеют митохондрий, необходимых для осуществления двух других путей катаболизма. Таким образом, вся АТФ в этих клетках производится за счет гликолиза. Кроме того, некоторые типы скелетных мышц содержат значительное количество гликолитических ферментов, но мало митохондрий. Во время интенсивной мышечной работы гликолиз в этих клетках обеспечивает синтез большей части АТФ, что сопряжено с продукцией большого количества лактата (Белые волокна (тип IIb) содержат меньше миоглобина и митохондрий, что свидетельствует о низком уровне окислительных реакций. Они содержат значительное количество гликогена и обладают высокой анаэробной активностью, что приводит к быстрому накоплению молочной кислоты и развитию последующей «усталости» мышц).
Приведенные примеры представляют собой исключения, поскольку большинство клеток не содержат в достаточных количествах гликолитических ферментов, либо глюкозы для того, чтобы обеспечить благодаря одному лишь гликолизу высокую скорость образования АТФ, необходимую для удовлетворения энергетических потребностей. Таким образом, в анаэробных условиях бОльшая часть клеток не способна функционировать в течение длительного времени.
Наш разговор о гликолизе сфокусирован на глюкозе, основном углеводе, входящем в гликолиз. Однако другие углеводы, такие как фруктоза, образующаяся из дисахарида сахарозы (столовый сахар), и галактоза, образующаяся из дисахарида лактозы (молочный сахар), также могут использоваться в гликолизе.

Табл. «Характеристика гликолиза» суммирует основные свойства процесса гликолиза
ЦИКЛ КРЕБСА
Цикл Кребса (известен как цикл трикарбоновых кислот или цикл лимонной кислоты), названный так в честь Ганса Кребса, который исследовал промежуточные стадии этого процесса. Является вторым из трех путей, вовлеченных в катаболизм молекул «топлива» и продукцию АТФ. В этом цикле используются молекулярные фрагменты, образующиеся при распаде углеводов, жиров и белков. В результате образуется двуокись углерода, атомы водорода (половина из которых связана с коферментами) и небольшое количество АТФ. Ферменты этого метаболического пути находятся внутри митохондрий, в матриксе.
Рис. Структуры, типичные для человеческой клетки
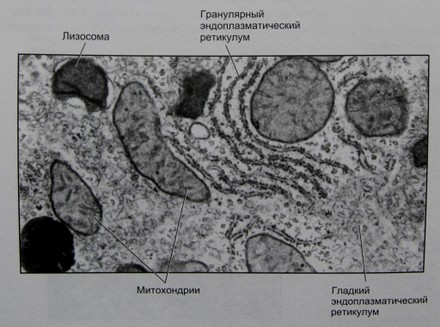
Электронная микрофотография
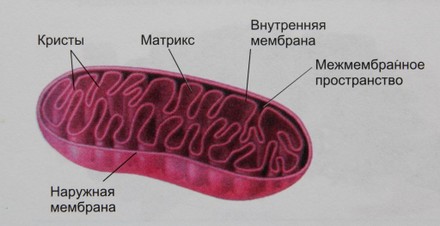
Рис. Митохондрия
Молекулой входящей в цикл Кребса, является ацетилкоэнзим А (ацетилКоА). Коэнзим А образуется из пантотеновой кислоты (одного из витаминов группы В) и функционирует как переносчик ацетильных групп, содержащих два атома углерода, от одной молекулы к другой. Эти ацетильные группы происходят либо из пирувата, который, как мы видели, является конечным продуктом аэробного гликолиза или образуется при распаде жирных кислот и некоторых аминокислот, что мы увидим в следующем разделе.
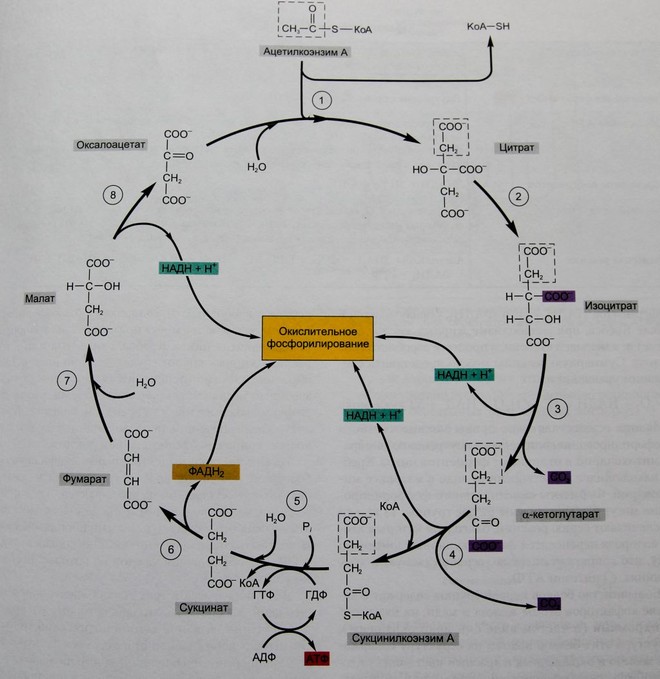
Рис. Цикл Кребса
Пируват при входе в митохондрии из цитозоля превращается в ацетилКоА и СО2.
Цикл Кребса начинается с переноса ацетильной группы ацетилКоА на четырехуглеродную молекулу, оксалоацетат, что приводит к образованию шестиуглеродной молекулы, цитрата. На третьей, а затем и на четвертой реакции цикла образуется по молекуле СО2. Таким образом, два атома углерода входят в цикл в виде ацетильной группы, прикрепленной к КоА, и два атома углерода (хотя не те же самые) уходят в виде СО2. Заметим также, что кислород, проявляющийся в СО2, происходит не от молекулярного кислорода, а из карбоксильных групп интермедиатов цикла Кребса.
В оставшейся части цикла четырехуглеродная молекула, образовавшаяся в реакции 4, модифицируется в серии реакций, что приводит к появлению четырехуглеродной молекулы оксалоацетата, становящейся способной акцептировать другую ацетильную группу, в результате чего цикл повторяется.
Здесь мы приходим к ключевому факту: в дополнение к образованию двуокиси углерода интермедиаты цикла Кребса производят атомы водорода, большая часть из которых переносится на коэнзимы НАД2+ и ФАД, образуя НАДН и ФАДН2. Поскольку окислительное фосфорилирование необходимо для регенерации свободных от водорода форм этих коферментов, цикл Кребса может осуществляться только в аэробных условиях. В митохондриях нет метаболического пути, который может удалить водород от этих коферментов в анаэробных условиях.
Мы до сих пор ничего не сказали о том, как в цикле Кребса образуется АТФ. Фактически, непосредственно в цикле Кребса образуется только одна молекула АТФ, это происходит в реакции 5. Образование АТФ из ГТФ является единственным механизмом, с помощью которого в цикле Кребса образуется АТФ. Почему же цикл Кребса столь важен? Потому что атомы водорода, перенесенные на коферменты в этом цикле (плюс свободные протоны), используются в следующем катаболическом пути, окислительном фосфорилировании для образования больших количеств АТФ.

Табл. «Характеристики цикла Кребса» суммирует характеристики реакций, входящих в цикл Кребса.
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Это третий, и в количественном отношении наиболее важный механизм, благодаря которому энергия, присущая молекулам «топлива», может превращаться в энергию АТФ.
Основные принципы, лежащие в основе этого механизма, просты: источником энергии, трансформируемой в АТФ, является энергия, освобождающаяся при соединении атомов водорода с молекулярным кислородом, вследствие чего образуется вода. Водород поступает от коферментов НАДН + Н+ и ФАДН2, образующихся в цикле Кребса, при метаболизме жирных кислот и, в меньшей степени, в процессе аэробного гликолиза.
Белки, осуществляющие процесс окислительного фосфорилирования, встроены во внутреннюю мембрану митохондрий в отличие от ферментов цикла Кребса, находящихся в растворенном виде в матриксе митохондрий. Ферменты окислительного фосфорилирования могут быть разделены на две группы:
1) те, что обеспечивают серию реакций, благодаря которым атомы водорода переносятся на молекулярный кислород
2) те, что сопрягают энергию, освобождаемую в этих реакциях, с синтезом АТФ
Большинство белков первой группы содержат в качестве кофакторов атомы железа и меди, их называют цитохромами (в чистом виде они ярко окрашены). Структура этих белков похожа на структуру содержащих железо и окрашенных в красный цвет молекул гемоглобина, связывающих кислород в эритроцитах. Цитохромы образуют компоненты электронпереносящей цепи, в которой два электрона атомов водорода сначала переносятся с НАДН + Н+ или ФАДН2 к одному из элементов этой цепи. Затем эти электроны переносятся на другие компоненты цепи, часто к атомам железа или меди, входящим в состав этих белков, а потом далее, пока, наконец, не доходят до молекулярного кислорода. Соединяясь с ним, электроны и атомы водорода (протоны) образуют воду. Источником протонов являются или свободные ионы водорода, или же коферменты, переносящие водород (они же являются источником электронов). От коферментов ионы водорода освобождаются в начале электронпереносящей цепи, когда электроны атомов водорода переносятся на цитохромы.
Важно отметить, что помимо переноса водородов коферментов к воде эти процессы обеспечивают регенерацию свободных от водорода форм коферментов, которые затем вновь могут принимать два водорода от интермедиатов цикла Кребса, гликолиза или в пути распада жирных кислот. Таким образом, электронпереносящая цепь обеспечивает аэробный механизм регенерации свободных от водорода форм коферментов, в то время как описанный ранее анаэробный механизм, использующийся только в гликолизе, сопряжен с образованием лактата.
Повторим, что бОльшая часть АТФ, образуемой в организме, синтезируется во время окислительного фосфорилирования в результате преобразования атомов водорода, источником которых является, главным образом цикл Кребса, обеспечивающий распад углеводов, жиров и белков. Таким образом, митохондрии, где происходит окислительное фосфорилирование и цикл Кребса, можно рассматривать как основной источник энергии клетки. Кроме того, как мы уже видели, в этих органеллах потребляется бОльшая часть вдыхаемого кислорода и образуется бОльшая часть углекислого газа, который мы выдыхаем.

Таблица «Характеристики окислительного фосфорилирования» суммирует основные характеристики этого процесса.
МЕТАБОЛИЗМ УГЛЕВОДОВ, ЖИРОВ И БЕЛКОВ
Описав три пути, благодаря которым энергия трансформируется в АТФ, мы теперь рассмотрим, как каждая из трех классов молекул «топлива» – углеводы, жиры и белки – входит в метаболические пути, обеспечивающие генерацию АТФ. Мы рассмотрим синтез этих топливных молекул и пути их превращения, а также контроль за превращением одного класса этих соединений в другой. Такие анаболические пути используются также для синтеза молекул, функции которых не связаны с запасание и освобождением энергии. Например, при наличии нескольких дополнительных ферментов пути для синтеза жиров используются и для синтеза фосфолипидов, являющихся структурным компонентом мембран.
МЕТАБОЛИЗМ УГЛЕВОДОВ
Катаболизм углеводов
В предыдущих подразделах мы подробно рассмотрели основные пути катаболизма углеводов: распад глюкозы по гликолитическому пути до пирувата или лактата и превращение пирувата в двуокись углерода и воду с использованием цикла Кребса и окислительного фосфорилирования.
Количество энергии, освобождаемой при превращении глюкозы в двуокись углерода и воду, составляет 686 ккал/моль глюкозы.
Как отмечалось ранее, около 40% этой энергии переносится на АТФ. Как мы видели, на субстратном уровне во время гликолиза в сумме образуется 2 молекулы АТФ, еще 2 формируются во время цикла Кребса из ГТФ, по одной на каждую молекулу пирувата, входящую в цикл. Основная часть молекул АТФ, возникающих при катаболизме глюкозы (34 моль/ моль глюкозы) синтезируется во время окислительного фосфорилирования за счет водородов, образующихся на различных стадиях распада глюкозы.
Напомним, что в отсутствие кислорода при превращении глюкозы в лактат может быть образовано только 2 молекулы АТФ. Это обеспечивает использование только 2% всей энергии, запасенной в глюкозе. Таким образом, эволюция аэробного метаболизма существенно увеличила количество энергии, доступной клетке вследствие катаболизма глюкозы. Например, если мышца во время сокращения потребляет 38 молекул АТФ, это количество может быть получено благодаря распаду 1 молекулы глюкозы в присутствии кислорода или 19 молекул глюкозы в анаэробных условиях.
Однако важно отметить, что хотя в анаэробных условиях образуется только 2 молекулы АТФ на молекулу глюкозы, благодаря гликолитическому пути могут быть получены значительные количества АТФ, если в лактат превратится большое количество глюкозы. Такая утилизация энергии, имеющейся в топливе, неэффективна, однако это позволяет продолжать производить АТФ в таких анаэробных условиях, какие наблюдаются при интенсивной физической нагрузке.
Запасание гликогена
Небольшие количества глюкозы в организме могут быть запасены для её использования в случае, когда она не всасывается в кровь из желудочно-кишечного тракта. Глюкоза запасается в виде полисахарида гликогена главным образом в скелетных мышцах и печени.
Гликоген синтезируется из глюкозы метаболическим путем, представленным на рисунке «Пути синтеза и распада гликогена». Ферменты его синтеза и распада локализованы в цитозоле. Первая стадия синтеза гликогена – это перенос фосфата от АТФ к глюкозе с образованием глюко-6-фосфата, то есть то же самое, что и первая стадия гликолиза. Таким образом, глюко-6-фосфат может быть разрушен до пирувата или использоваться для образования гликогена.
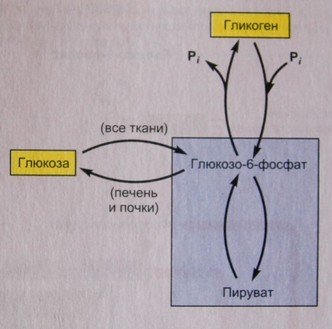
Рис. Пути синтеза и распада гликогена
Когда в печени или мышцах есть избыток глюкозы, ферменты пути синтеза гликогена активируются с помощью химических сигналов, одновременно ингибируются ферменты, которые обеспечивают распад гликогена. Это сочетание воздействий приводит к запасанию глюкозы в виде гликогена. Когда глюкозы недостаточно, наблюдается обратная комбинация стимуляции и ингибирования ферментов, вследствие чего гликоген распадается до глюко-6-фосфата.
Превращение глюко-6-фосфата может пойти двумя путями:
1) в большинстве клеток, включая скелетную мышцу, он входит в гликолиз, где распадается, обеспечивая энергию для синтеза АТФ
2) в печени (и клетках почек) глюко-6-фосфат может превращаться в свободную глюкозу за счет удаления фосфатной группы, после чего та может выйти из клетки и попасть в кровь для использования в качестве топлива другими клетками.
Синтез глюкозы
Помимо того, что глюкоза может образовываться в печени вследствие распада гликогена, она может синтезироваться в печени и почках из интермедиатов, возникающих при катаболизме глицерина и некоторых аминокислот. Этот процесс образования новых молекул глюкозы известен как глюконеогенез (Метаболический путь, приводящий к образованию глюкозы из неуглеводных соединений, в частности, пирувата. Он служит важным источником глюкозы в условиях недостаточного количества гликогена, например, после длительного голодания или тяжёлой физической работы).
Основной субстрат глюконеогенеза – пируват, создающийся из лактата и нескольких аминокислот во время распада белков. Кроме того, как мы увидим, глицерин, образующийся при гидролизе триацилглицеридов, может быть превращен в глюкозу с помощью метаболического пути, в котором пируват отсутствует.
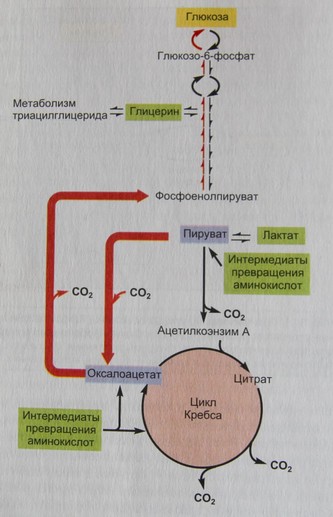
Рис. Глюконеогенез
В глюконеогенезе, протекающем в печени и почках, используются многие, но не все ферменты гликолиза, поскольку большая часть реакций гликолиза обратима. Однако реакции 1,3 и 10 (см. рисунок «Гликолиз») необратимы, в связи с чем для образования глюкозы из пирувата необходимо использовать дополнительные ферменты.
Пируват превращается в фосфоэнолпируват благодаря серии реакций, протекающих в митохондриях. Дополнительная серия реакций приводит к переносу из митохондрий в цитозоль четырехуглеродного интермедиата, возникающего из оксалоацетата, и его превращению в фосфоэнолпируват в цитозоле. Повышение концентрации фосфоэнолпирувата приводит к обращению стадий гликолитического пути до реакции 3, в которой для превращения фруктозо-1,6-бисфосфата во фруктозо-6-фосфат необходим иной фермент, нежели тот, что используется в гликолизе. Далее от этой точки реакции также обратимы, в результате чего образуется глюкозо-6-фосфат, который может быть превращен в глюкозу в печени и почках или запасен в виде гликогена. Поскольку во время гликолитического превращения глюкозы в пируват энергия освобождается в виде тепла и синтезированной АТФ, для обращения этого пути необходима добавочная энергия. Суммарно на молекулу образованной глюкозу в реакциях глюконеогенеза потребляется 6 молекул АТФ.
В гликолизе и глюконеогенезе используется много одних и тех же ферментов. Поэтому возникает вопрос: что же контролирует направление реакций по этому пути? Какие условия определяют, распадается ли глюкоза до пирувата или пируват превращается в глюкозу? Ответ заключается в том, каковы концентрации глюкозы и пирувата в клетке, а также в регуляции активности ферментов, вовлеченных в необратимые стадии пути: этот контроль осуществляется через различные гормоны, изменяющие концентрации и активности этих ключевых ферментов.
МЕТАБОЛИЗМ ЖИРОВ
Катаболизм жиров
Триацилглицерид (жир) состоит из трех жирных кислот, связанных с глицерином. Жиры составляют основную часть (около 80%) энергии, запасаемой в организме. В условиях покоя приблизительно половина энергии, используемой в таких тканях, как мышцы, печень и почки, появляется благодаря катаболизму жирных кислот.
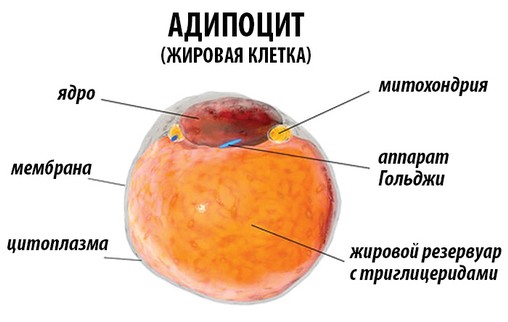
Хотя бОльшая часть клеток запасает небольшое количество жиров, значительная их часть находится в специализированных клетках, называемых адипоцитами. Почти вся цитоплазма этих клеток заполнена одной большой жировой каплей. Кластеры адипоцитов образуют жировую ткань, которая в основном находится под кожей. Функция адипоцитов – обеспечение синтеза и запасание триацилглицеридов в то время, когда потребляется пища. Когда пища не всасывается из кишечного тракта, адипоциты освобождают жирные кислоты и глицерин в кровь для того, чтобы они поглощались и использовались другими клетками для обеспечения образования АТФ.
Рисунок «Путь катаболизма жирных кислот» показывает пути катаболизма жирных кислот, обеспечивающихся ферментами, представленными в матриксе митохондрий. Распад жирных кислот инициируется связыванием молекулы коэнзима А с карбоксильной группой жирной кислоты. Эта начальная стадия сопровождается распадом АТФ до АМФ и 2 молекул Рi.
Затем коэнзим А-производные жирных кислот проходят через серию реакций, называемых бета-окислением. При этом молекула ацетилкоэзима А расщепляется с удалением конца жирной кислоты и переносом двух пар атомов водорода на коферменты (одна пара переносится на ФАД, а другая – на НАД+). Затем атомы водорода от коферментов передаются в путь окислительного фосфорилирования, где происходит образование АТФ.

Рис. Путь катаболизма жирных кислот
Когда ацетилкоэнзим А отщепляется от остатка жирной кислоты, добавляется другая молекула коэнзима А (для этой стадии АТФ не нужен), и последовательность реакций повторяется. Каждое прохождение через эти последовательность приводит к укорочению цепи жирной кислоты на 2 атома углерода до тех пор, пока все они не будут перенесены на молекулы коэнзима А. как мы видели, эти молекулы входят затем в цикл Кребса и через него в окислительное фосфорилирование и распадаются до CO2 и АТФ.
Как много АТФ образуется в результате общего катаболизма жирных кислот? Большая часть жирных кислот организма содержит от 14 до 22 атомов углерода (чаще всего 16 или 18). Катаболизм одной 18-углеродной насыщенной жирной кислоты дает 146 молекул АТФ. Как мы видели, катаболизм одной молекулы глюкозы дает 38 молекул АТФ. Принимая во внимание различия в молекулярной массе жирной кислоты и глюкозы, количество АТФ, образованной из 1 г жира, примерно в 2,5 раза больше, чем производимое при катаболизме 1 г углеводов. Если бы средний организм, потребляющий энергию, запасал топливо в виде углеводов, а не жиров, вес тела был бы в среднем на 30% больше при запасе того же количества энергии. Таким образом, основной шаг на пути экономии топлива происходит, когда животные приобретают в процессе эволюции способность запасать топливо в виде жира. Растения, напротив, запасают почти все свое топливо в качестве углеводов.
Синтез жиров
Синтез жирных кислот происходит в реакциях, которые являются почти полным обращением процесса их деградации. Однако, ферменты синтеза располагаются в цитозоле, в то время как ферменты, катализирующие распад жирных кислот, – в митохондриях.
Синтез жирных кислот начинается с цитоплазматического ацитилкоэнзима А, который переносит ацетильную группу на другую молекулу ацитилкоэнзима А, образуя четырехуглеродную цепь. За счет повторения этого процесса в длинноцепочечные жирные кислоты одномоментно встраиваются 2 атома углерода, таким образом, все жирные кислоты, синтезированные в организме, содержат четное количество атомов углерода.
Когда жирная кислота образована, за счет связывания жирной кислоты с каждой из трех гидроксильных групп глицерина может быть синтезирован триацилглицерид.
Сравним молекулы, образуемые вследствие катаболизма глюкозы, с теми, что необходимы для синтеза жирных кислот и а-глицерофосфата. Во-первых, ацетилкоэнзим А, молекула, с которой начинается синтез жирных кислот, может быть образована из пирувата, конечного продукта гликолиза. Во-вторых, другие ингредиенты: коферменты, связывающие водород, и АТФ, синтезируются во время катаболизма углеводов. В-третьих, а-глицерофосфат может быть образован из интермедиатов метаболизма глюкозы. неудивительно, что бОльшая часть углеводов пищи превращается в жир и запасается в жировой ткани вскоре после всасывания в желудочно-кишечном тракте. По закону действия масс за счет увеличения концентрации интермедиатов глюкозы и благодаря специфической гормональной регуляции ключевых ферментов происходит ускорение этого превращения.
Важно отметить, что жирные кислоты или, более точно, ацетилкоэнзим А, возникающий в результате их распада, не могут быть использованы для синтеза новых молекул глюкозы. Таким образом, глюкозу можно легко превратить в жир, но жирные кислоты, входящие в его состав, не могут быть превращены в глюкозу. Однако трехуглеродный остов глицерина, являющегося составной частью жира, может превращаться в интермедиаты глюконеогенеза и увеличивать уровень глюкозы.
МЕТАБОЛИЗМ БЕЛКОВ И АМИНОКИСЛОТ
Катаболизм белков
В отличие от сложностей, которые наблюдаются при синтезе белка, при катаболизме белков необходимо лишь несколько ферментов, называемых протеазами, для того, чтобы разрушить пептидную связь между аминокислотами.
Аминокислоты могут катаболизироваться, обеспечивая энергию для синтеза АТФ, они могут также образовывать интермедиаты, используемые для синтеза ряда молекул, иных, чем белки. Поскольку в организме представлено 20 различных аминокислот, может образовываться большое количество интермедиатов и существует множество путей для их преобразования.
Несколько основных типов реакций, общих для большей части этих путей, могут дать представление о катаболизме аминокислот.
В отличие от углеводов и жиров, аминокислоты, помимо атомов углерода, водорода и кислорода, содержат атомы азота (в составе аминогруппы). Как только содержащая азот аминогруппа удаляется, остающаяся часть большинства аминокислот может быть метаболизирована до интермедиатов, способных входить в гликолиз или цикл Кребса.
Вот два типа реакций, в которых происходит удаление аминогрупп:
1) Окислительное дезаминирование – аминогруппа образует молекулу аммиака (NH3) и заменяется атомом кислорода, источником которого является молекула воды. В результате образуется кетокислота – название скорее категории молекул, а не специфической молекулы.
2) Трансаминирование – в этой реакции аминогруппа переносится от аминокислоты к кетокислоте. Отметим, что кетокислота, к которой переносится аминогруппа, становится аминокислотой.
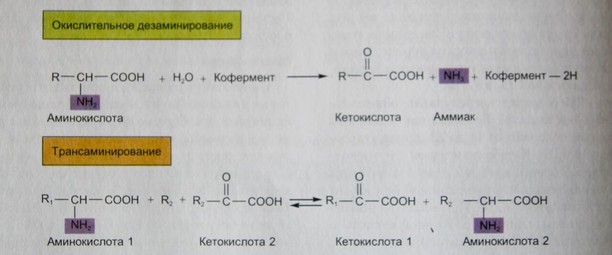
Рис. Окислительное дезаминирование и трансаминирование аминокислот
Азот, происходящий из аминогрупп, может быть также использован клетками для синтеза других важных содержащих азот молекул, таких как пуриновые и пиримидиновые основания, входящие в состав нуклеиновых кислот.
Таким образом, аминокислоты могут быть источником энергии, а некоторые из них – превращаться в углеводы и жиры.
Окислительное дезаминирование аминокислоты дает аммиак. Это вещество, высокотоксичное для клеток. Если аммиаку позволить аккумулироваться, он легко проникает через клеточные мембраны и выходит в кровь, переносящую его к печени. Печень содержит ферменты, которые могут связывать две молекулы аммиака с двуокисью углерода с образованием мочевины. Относительно нетоксичная мочевина является основным содержащим азот продуктом катаболизма белков. Она выходит в кровь из печени и выводится почками в мочу.
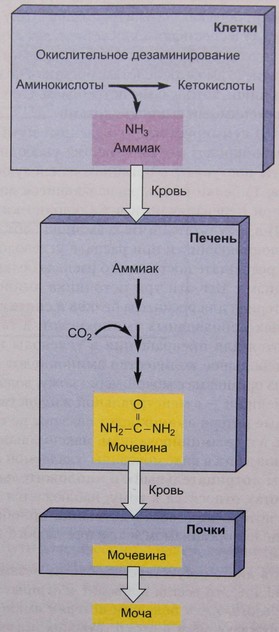
Рис. Образование и экскреция мочевины
Синтез белков
Две кетокислоты: пировиноградная и а-кетоглутаровая – могут образовываться при распаде глюкозы и затем трансформироваться, превращаясь в аминокислоты глутамат и аланин. Таким образом, глюкоза используется для синтеза определенных аминокислот, поскольку другие аминокислоты, содержащиеся в пищевых продуктах, поставляют аминогруппы для трансаминирования. Однако лишь 11 из 20 аминокислот могут образовываться благодаря этому процессу, поскольку 9 специфических кетокислот синтезируются из других интермедиатов. Аминокислоты, соответствующие этим кетокислотам, организм должен получать из пищи, которую мы потребляем они называются незаменимыми аминокислотами.
Все свободные аминокислоты поступают в организм из следующих источников:
1) белки пищи, распадающиеся до аминокислот при переваривании в желудочно-кишечном тракте
2) в результате синтеза аминокислот из кетокислот, появляющихся при распаде углеводов и жиров
3) в результате постоянного распада белков самого организма
Очень небольшое количество аминокислот и белка уходит из организма с мочой, через кожу, волосы, ногти, а у женщин – с менструальной жидкостью. Максимальные потери аминокислот связаны не с их экскрецией, а с дезаминированием, максимальной потерей атомов азота в виде мочевины, удаляемой с мочой. Термины «отрицательный» и «положительный баланс азота» относятся к тому, наблюдается ли суммарная потеря или, соответственно, приобретение аминокислот организмом в течение любого периода времени.
Если в диете отсутствует любая из незаменимых аминокислот, это всегда приводит к отрицательному балансу азота, то есть к большим потерям аминокислот.
ОБРАЗОВАНИЕ В ПЕЧЕНИ АЦЕТОУКСУСНОЙ КИСЛОТЫ
Большая часть начального расщепления жирных кислот осуществляется в печени, особенно если необходимо использовать в энергетических целях чрезвычайно большие количества липидов. Однако печень использует для своих внутренних метаболических процессов только маленькую часть жирных кислот. Когда от цепочки жирной кислоты отщепляется ацетил-КоА, 2 молекулы этого вещества, объединяясь, формируют молекулу ацетоуксусной кислоты, которая затем транспортируется кровью в другие клетки организма, где она может использоваться для получения энергии.
Часть ацетоуксусной кислоты превращается в β-гидроксимасляную кислоту, совсем небольшое количество превращается в ацетон.
Ацетоуксусная кислота, β-гидроксимасляная кислота и ацетон свободно диффундируют через мембраны клеток печени и транспортируются кровью к периферическим тканям. Здесь эти вещества вновь диффундируют через мембраны внутрь клеток, где наблюдаются обратные реакции и образуются молекулы ацетил-КоА. Ацетил-КоА, в свою очередь, вступает в цикл Кребса и окисляется, давая энергию в форме АТФ. В норме ацетоуксусная и β-гидроксимасляная кислоты, попадающие в кровь, так быстро транспортируются к тканям, что их общая концентрация в плазме редко превышает 3 мг/дл. Реально, несмотря на маленькую концентрацию в крови, транспортируются большие количества этих веществ, как это происходило в случае транспорта свободных жирных кислот. Большая скорость транспорта этих двух типов веществ является результатом их высокой растворимости в мембранах клеток-мишеней, что позволяет им практически мгновенно диффундировать внутрь клеток.
КЕТОЗ ПРИ ГОЛОДАНИИ И ПРИВЫКАНИЕ К ЖИРНОЙ ПИЩЕ
Временами концентрация ацетоуксусной, β-гидроксимасляной кислот и ацетона во много раз превышает их нормальную концентрацию в крови и интерстициальной жидкости. Такое состояние называют кетозом, т.к. ацетоуксусная кислота является кетокислотой, а три компонента называют кетоновыми телами. Кетоз развивается, прежде всего, при голодании, сахарном диабете и в случаях, когда в пищевой рацион включены главным образом жиры. В этих случаях углеводы не участвуют в процессах метаболизма (при голодании и когда рацион состоит преимущественно из жиров — по причине их отсутствия, а при диабете — в связи с недостаточным количеством инсулина, делающего возможным поступление глюкозы в клетки). Если углеводы не используются для получения энергии, почти всю энергию организм должен получать путем метаболизма жиров. Отсутствие углеводов автоматически увеличивает скорость извлечения жирных кислот из жировой ткани. Кроме того, некоторые факторы, увеличивающие секрецию гормонов, например: гормонов коры надпочечников (глюкокортикоидов) или глюкагона (гормона поджелудочной железы), либо уменьшающие продукцию инсулина, приводят к увеличению высвобождения жирных кислот из жировой ткани. В результате появляются огромные количества жирных кислот, которые:
1) используются периферическими тканями на энергетические нужды
2) превращаются в печени в кетоновые тела.
Кетоновые тела постепенно покидают печень и доставляются к тканям. Клетки ограничены в возможности окисления кетоновых тел по нескольким причинам. Наиболее важная из них следующая. Один из продуктов метаболизма углеводов — оксалоацетат — необходим для взаимодействия с ацетилкоэнзимом А перед его вступлением в цикл Кребса. В связи с этим дефицит оксалоацетата, производного углеводов, ограничивает вхождение ацетилКоА в цикл Кребса, и когда одновременно выделяются большие количества ацетоуксусной кислоты и других кетоновых тел из печени, концентрация ацетоуксусной и β-гидроксимасляной кислот временами увеличивается более чем в 20 раз относительно нормы, что ведет к резко выраженному ацидозу. Ацетон, образующийся в связи с кетозом, является летучим веществом, частично удаляемым легкими во время выдоха, что может служить диагностическим признаком кетоза.
Если постепенно переходить от рациона, содержащего углеводы, к рациону, состоящему почти из одних жиров, организм постепенно привыкает использовать в гораздо больших количествах ацетоуксусную кислоту, чем обычно, и в таких случаях кетоз не возникает. Например, у эскимосов, которые временами живут на рационе, почти полностью состоящем из жиров, кетоз не развивается. Несомненно, некоторые факторы, действие которых до сих пор не объяснено, ускоряют метаболизм ацетоуксусной кислоты в клетках. Через несколько недель даже клетки мозга, которые в норме получают практически всю энергию из глюкозы, могут получать от 50 до 75% необходимой им энергии из жиров.
НЕЗАМЕНИМЫЕ КОМПОНЕНТЫ ДИЕТЫ
Около 50 веществ, необходимых для оптимального функционирования организма, не синтезируются в организме или синтезируются со скоростью недостаточной для поддержания нужного соотношения между синтезом и распадом или выведением. Такие вещества называют незаменимыми компонентами диеты (смотрите таблицу ниже).

Поскольку они выводятся из организма с определенной скоростью, то должны постоянно поступать с пищей.
ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ
Многие составляющие пищи не могут быть реабсорбированы напрямую, для начала они должны быть подвергнуты ферментативному гидролизу до небольших молекул:
• триглицериды – до свободных жирных кислот и моноглицеридов
• белки – до аминокислот и ди- и трипептидов
• полисахара – до моносахаров
Лишь такие молекулы могут транспортироваться через эпителий тонкого кишечника.
Химические процессы переваривания (гидролиз), в которых принимает участие соляная кислота, желчные соли и множество ферментов, идут параллельно с механической обработкой, которая объединяет жевание во рту, измельчение и эмульгирование с помощью моторики дистального отдела желудка, интенсивное перемешивание во всем желудочно-кишечном тракте и разведение за счет воды пищеварительных соков.
Давайте рассмотрим коротко процесс переваривания и всасывания углеводов и белков, и немного более подробно – жиров.
Углеводы
Крахмал и полисахара являются наиболее важными углеводами пищи. Крахмал расщепляется амилазами слюнных желез и поджелудочной железы. Возникающие при этом полисахара вместе с дисахарами пищи гидролизируются до моносахаров с помощью мембранных гидролаз щеточной каемки эпителия тонкого кишечника.
Реабсорбцию моносахаров из просвета кишечника обеспечивают специальные переносчики, локализованные в мембране щеточной каемки эпиталиальной клетки.
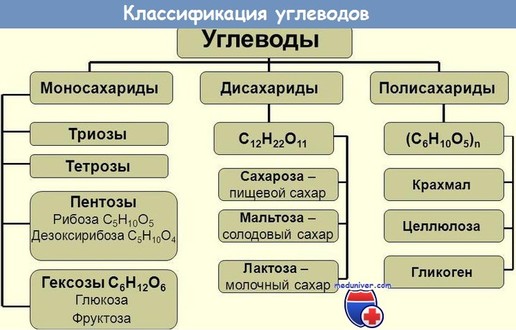
С обычной пищей ежедневно в организм поступает более 300 г углеводов:
• полисахара – 64% крахмал, 0,5% гликоген
• дисахара – 26% сахар (сахароза), 6,5% молочный сахар (лактоза)
• моносахара – 3% (прежде всего фруктоза)
После полного гидролиза во время переваривания из них образуются моносахара:
• глюкоза (80%)
• фруктоза (14%)
• галактоза (5%)
Белки
Пепсины желудочного сока расщепляют белки пищи до средних и коротких пептидов. Этот процесс продолжается в тонком кишечнике, где трипсин и хемотрипсин отщепляют олигопептиды, которые расщепляются олигопептидазами щеточной каемки до аминокислот, ди- и трипептидов. Они реобсорбируются клетками эпителия тонкого кишечника с помощью белков-переносчиков, которые используют градиент Na+ для вторично активного транспорта продуктов расщепления белков в клетку.
Жиры
Жиры пищи на 90% состоят из триацилглицеринов, а остальное количество – из холестерина, остатков эфира холестерина, фосфолипидов, сфинголипидов.

Переваривание жиров начинается в желудке с помощью неспецифической липазы, выделяемой клетками желез Эбнера, расположенных в основании языка. Переваривание продолжается в двенадцатиперстной кишке, где на химус действуют липазы поджелудочной железы: фосфолипаза А2 и еще одна неспецифическая липаза.
Для переваривания жиров необходимы желчные соли; они способствуют эмульгированию жиров и образуют мицеллы с продуктами переваривания триацилглицеринов (свободные жирные кислоты, моноацилглицерины). Мицеллы содержат также холестерин и жирорастворимые витамины. Мицеллы вступают в контакт с мембраной клеток кишечного эпителия, что необходимо для всасывания жиров. Поступающие в клетки жирные кислоты, моноацилглицерины и холестерин этерифицируются (соединяются), что способствует образованию хиломикронов – соединений моноацилглицеринов и холестерина с фосфолипидами и апопротеинами (белковая часть липидных комплексов). Хиломикроны попадают в лимфу, с которой они поступают в систему кровообращения, минуя печень. Для желчных солей в тонком кишечнике существует реабсорбционный механизм (кишечно-печеночная рециркуляция желчных солей).
Количество ежедневно поступающих с пищей жиров сильно варьируется (между 10 и 250 г) и в среднем составляет от 60 до 100 г.
Сначала эмульгирование, а затем переваривание
Поскольку расположенные в основании языка железы Эбнера выделяют неспецифическую липазу, то переваривание жиров начинается сразу же после проглатывания пищи. В течение 3 – 4 часов, пока пища содержащая жиры находится в желудке, переваривается до 30% жиров.
Наряду с активностью липазы особый вклад в переваривание жиров вносят перистальтические сокращения дистального отдела желудка, обеспечивающие эмульгирование жиров.
В двенадцатиперстной кишке содержащий жиры химус смешивается с желчными солями и липазами сока поджелудочной железы. Далее, под влиянием моторики кишечника продолжается сложная эмульсия, которая позволяет все более и более мелким мицеллам проникать в просветы между ворсинками эпителия тонкого кишечника.
Основным местом переваривания жиров является тонкий кишечник вплоть до верхних отделов подвздошная кишки. Основной гидролиз жиров осуществляется различными липазами, выделяемыми поджелудочной железой.
Желчные соли в качестве посредника
Как уже упоминалось, желчные соли играют ключевую роль в переваривании и всасывании жиров. Поскольку и непереваренные жиры, и продукты их расщепления, прежде всего свободные жирные кислоты и моноацилглицерины, не растворимы в воде, для их растворения необходимы желчные соли. С одной стороны, желчные соли способствуют эмульгированию жиров. Эмульгирование является важным процессом, поскольку большая поверхность эмульсионных капель облегчает липолиз.
Из этого можно сделать важный вывод, что для усвоения жиров нам необходимы желчные соли, которые накапливаются в желчном пузыре. А для их образования необходимо иметь в своем рационе жиры!
ВЛИЯНИЕ ГОРМОНОВ
В нашем организме выделяют 5 самых главных гормонов, влияющих на гомеостаз организма. Это кортизол, инсулин, тестостерон, эстроген и тиреоидные гормоны.
Когда наша эндокринная система работает нормально и эти гормоны находятся в состоянии равновесия, они ведут себя как мудрые наставники, отправляя каждой клетке команды типа «сделай то» и «сделай так». В этом случае эти гормоны способны обеспечить нашему организму гомеостаз – состояние, когда у нас стабильное настроение, постоянный нормальный вес, хорошее пищеварение, чистая кожа, густые волосы. К сожалению, редко кто из нас сегодня может похвастаться отличным здоровьем, нормальным весом и непеременчивым настроением.
Коротко вспомним, как проявляет себя достаточное или недостаточное количество каждого из этих гормонов и как мы можем повлиять при употреблении в пищу определенных продуктов.
Кортизол
Вырабатывается кортизол в надпочечниках и считается основным гормоном, отвечающим за стрессоустойчивость. Повышение уровня кортизола в крови влечет за собой увеличение кровяного давления и сахара в крови. Если уровень кортизола выше нормы длительное время, то это непременно ведет к повышенной раздражительности, набору веса, нарушению обмена веществ и повышению уровня сахара в крови. Первые симптомы повышения уровня кортизола – проблемы с похудением, частая смена настроения, бессонница, плохая память, тревожность, отсутствие желания что-то делать, тяга к сладкому и соленому.
Есть масса продуктов и лекарственных трав, снижающих кортизол. Таким действием обладают популярные у нас женьшень, родиола розовая, гинкго билоба и менее известный корень ашвагандхи. Помогут оливковое масло extra virgin, диета с высоким содержанием жиров и низким — углеводов, а также рыба и бобовые.
Инсулин
Про этот гормон знают практически все, он вырабатывается в поджелудочной железе и снижает уровень глюкозы в крови. Когда уровень инсулина в крови повышен, клетки становятся невосприимчивыми к нему и сахар в крови повышается, что может привести даже к диабету. Первые симптомы повышения сахара в крови – постоянная сухость во рту, быстрая утомляемость, частое мочеиспускание и прибавка в весе. Нормальный уровень сахара в крови должен быть в пределах 3,6-5,8 моль/л натощак, если он выше, то это говорит о нарушении чувствительности к инсулину.
Чтобы восстановить этот дисбаланс, нужно регулярно кушать квашеную капусту и другие ферментированные овощи. Подойдут нежирное мясо рыбы и птицы, цельнозерновой и ржаной хлеб без рафинированной белой муки, гречка или овсянка. Овощи – выбор колоссален, так как почти все продукты с низким содержанием углеводов подходят для снижения инсулина. Особое место в снижении инсулина занимают зеленые овощи и зелень – сельдерей, шпинат, листья салата, руккола, сладкий перец и горошек, артишоки и др.
Тестостерон
Этот гормон вырабатывается в яичках у мужчин, в яичниках у женщин и надпочечниках. Его обычно называют мужским половым гормоном, он очень важен для поддержания тонуса мышц, роста костей и поддержания половой функции. При чрезмерном повышении его в крови у женщин начинают расти нежелательные волосы на лице и теле, появляются прыщи, нарушается менструальный цикл и может развиться бесплодие. У мужчин повышенный тестостерон может привести к раннему облысению, избыточному весу и чрезмерно агрессивному поведению.
Чтобы снизить уровень тестостерона в крови, надо в ежедневное меню питания включать продукты, богатые цинком. Это тыква, тыквенные семечки и зеленые бобы. Кстати, зачастую появление прыщей на лице у подростков провоцирует дефицит цинка, что приводит к повышению уровня андрогенов – группы гормонов, к которой относится и тестостерон.
Эстроген
Эстроген – женский половой гормон, отвечающий за нормальное развитие женских проявлений в теле, такие как грудь, бедра и отсутствие нежелательных волос. При избытке эстрогена в организме у женщин могут развиться различные заболевания мочеполовой системы, такие как миома, нарушение менструального цикла, эндометриоз, сильное кровотечение и другие, а у мужчин фигура приобретает женские изгибы – наблюдается рост ягодиц, бедер и груди.
Вывести из организма избыточный эстроген хорошо помогают овощи семейства крестоцветных. Это цветная и листовая капуста, брокколи. В целом крестоцветные очищают организм от ненужных клеток, не давая им возможности ускорить процессы старения.
Тиреоидные гормоны
К этой группе гормонов относиться тироксин (Т4) и трийодтиронин (Т3). Вырабатываются они в щитовидной железе, нормальная работа которой напрямую зависит от содержания йода в нашем организме. При недостатке йода нарушается работа щитовидной железы, что приводит к снижению уровня тиреоидных гормонов и нарушению обмена веществ в организме целом. Симптомы замедленного метаболизма, вызванного дефицитом гормонов Т3 и Т4 – подавленное настроение, запоры, лишние килограммы, от которых невозможно избавиться, мышечные и суставные боли, непереносимость тепла и холода, вялость, усталость, сухая кожа и волосы, похожие на солому.
Хорошо известно, что при гипертиреозе уровень холестерина в крови падает, а при гипотиреозе – повышается.
Чтобы восполнить нехватку тиреодных гормонов надо в первую очередь кушать продукты, богатые йодом. Йода много в красной икре, морской капусте, печени трески, хурме, гречке и бразильских орехах. Кроме йода, при дефиците гормонов Т3 и Т4 рекомендуется употреблять в пищу продукты, содержащие селен и медь. Они улучшают работу щитовидной железы. Больше всего селена содержат также бразильские орехи.
АДРЕНАЛИН
Будучи родственником кортизола, адреналин, тем не менее, влияет на обмен веществ совсем иначе. И если кортикостероиды способствуют набору веса, то адреналин усиливает липолиз (распад жиров) и тормозит их образование. В результате усиливается мобилизация жирных кислот из жировых депо и повышается содержание неэстерифицированных жирных кислот в плазме крови.
Кортизол выделяется в ответ на страх, опасность или стресс, адреналин же вырабатывается в моменты возбуждения и драйва. Важное отличие в том, что, когда ситуация, какой бы сложной в точки зрения физического и нервного напряжения она не была, вызывает удовольствие, ну или хотя бы желание справиться с ней – это адреналин и состояние готовности к борьбе, то есть активация. А если ситуация подавляет и бороться в ней не хочется, тогда – это кортизол и состояние депрессии, то есть избегание.
Адреналин вызывает мощные метаболические эффекты в виде усиленного расщепления гликогена в печени и мышцах из-за активации фосфорилазы, а также подавление синтеза гликогена, угнетение потребления глюкозы тканями, что в целом ведет в гипергликемии (состояние, при котором в крови резко повышается уровень глюкозы).
Также адреналин блокирует действие кортикостероидов и запускает термогенезис – повышение уровня обмена веществ и повышение температуры тела, оба этих процесса способствуют сгоранию энергетических запасов.
Кроме того, адреналин способствует резкому снижению аппетита, являясь веществом, которое активизируется при работе симпатической нервной системы. Адреналин вызывает активацию распада жира, мобилизацию в кровь жирных кислот и их окисление. Все эти эффекты противоположны действию инсулина, поэтому адреналин называют контринсулярным гормоном.
Адреналин усиливает окислительные процессы в тканях и повышает потребление ими кислорода.
ГОРМОНЫ ЖИРОВОЙ ТКАНИ
Жировая ткань продуцирует ряд гормонов:
• адипонектин
• эстроген
• лептин
• резистин
• цитокины
Коротко рассмотрим эти гормоны.
Эстроген – общее собирательное название подкласса стероидных женских половых гормонов, производимых, в основном, фолликулярным аппаратом яичников у женщин. Также производятся яичками у мужчин, корой надпочечников и другими внегонадными тканями (включая кости, мозг, жировую ткань, кожу и волосяные фолликулы) у обоих полов.
Важно отметить, что при значительном уменьшении объема жировой ткани, уровень эстрогена может сильно снижаться.
Адипонектин – гормон, который синтезируется и секретируется белой жировой тканью, преимущественно адипоцитами висцеральной области (а также плацентой во время беременности). Его секреция стимулируется инсулином. Участвует в регуляции уровня глюкозы и расщепления жирных кислот, предотвращает развитие атеросклероза и общих воспалительных процессов. Он влияет на прохождение сигнала от рецептора инсулина и тем самым препятствует возникновению инсулинрезистентности. Жирные кислоты в клетках мышц и печени под его действием окисляются быстрее, активных форм кислорода становится меньше, а диабет, если он уже есть, протекает легче. Более того, адипонектин регулирует работу самих адипоцитов.
Лептин (от др.греч. – тонкий) – пептидный гормон, регулирующий энергетический обмен. Оказывает анорексигенное действие (подавляет аппетит) и ускоряет расщепление жирных кислот. Снижение концентрации лептина ведёт к развитию ожирения. Лептин рассматривается в качестве одного из факторов патогенеза инсулиннезависимого сахарного диабета.
Резистин представляет собой антагонист инсулина, под его действием клетки сердечной мышцы снижают потребление глюкозы и накапливают внутриклеточные жиры. А сами адипоциты под влиянием резистина синтезируют намного больше факторов воспаления. Чем больше резистина в сыворотке, тем выше систолическое давление, шире талия, больше риск развития сердечно-сосудистых заболеваний.
Справедливости ради надо отметить, что разрастающаяся жировая ткань стремится исправить вред, причиняемый ее гормонами. С этой целью адипоциты больных ожирением в избытке производят еще два гормона: висфатин и апелин. Правда, их синтез происходит и в других органах, в том числе в скелетных мышцах и печени. В принципе эти гормоны противостоят развитию метаболического синдрома.
Висфатин действует подобно инсулину (связывается с инсулиновым рецептором) и снижает уровень глюкозы в крови, а еще очень сложным образом активирует синтез адипонектина. Но безусловно полезным этот гормон назвать нельзя, поскольку висфатин стимулирует синтез сигналов воспаления.
Апелин подавляет секрецию инсулина, связываясь с рецепторами бета-клеток поджелудочной железы, понижает артериальное давление, стимулирует сокращение клеток сердечной мышцы. При уменьшении массы жировой ткани его содержание в крови снижается. К сожалению, апелин и висфатин не могут противостоять действию других адипоцитных гормонов.
Цитокины – небольшие пептидные информационные молекулы. Цитокины имеют молекулярную массу, не превышающую 30 кДа.
Цитокин выделяется на поверхность клетки А и взаимодействует с рецептором находящейся рядом клетки В. Таким образом от клетки А к клетке В передаётся сигнал, который запускает в клетке В дальнейшие реакции.
Их основными продуцентами являются лимфоциты. Кроме лимфоцитов, их секретируют макрофаги, гранулоциты, Т-хелперы, Дендритные клетки, ретикулярные фибробласты, эндотелиальные клетки и другие типы клеток.
Они регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность и апоптоз, а также обеспечивают согласованность действия иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические воздействия.
Таким образом, мы можем сделать вывод, что гормональная активность жировой ткани объясняет, почему избыточный вес приводит к таким серьезным последствиям.
ВЛИЯНИЕ НА СЕРДЦЕ
Излишнее потребление насыщенных жиров может привести к повышению уровня холестерина в крови и предрасположенности к сердечно-сосудистым заболеваниям.
Напротив, некоторые жирные кислоты, в частности комплекс Омега 3 и Олеиновая кислота способствуют предотвращению сердечно-сосудистых заболеваний. Недостатком этих кислот является их легкая окисляемость. Особенно быстро эти кислоты окисляются при нагревании и при взаимодействии с воздухом. В результате появляется большое количество свободных радикалов, что негативно влияет на наш организм.
ХОЛЕСТЕРИН
(холестерол) с др.греч. «холе» - желчь и «остерос» - твердый; органическое соединение, природный полициклический липофильный спирт, содержится в клеточных мембранах всех животных, в том числе человека. Однако, его нет в клеточных мембранах растений и грибов, а также прокариотических организмов (археи, бактерии и т.д.).
Холестерин нерастворим в воде, растворим в жирах и органических растворителях. Холестерин легко синтезируется в организме из жиров, глюкозы, аминокислот.
Холестерин необходим для:
• обеспечения устойчивости клеточных мембран в широком интервале температур
• выработки витамина D
• выработки надпочечниками различных стероидных гормонов (включая: кортизол, альдостерон, половые гормоны: эстрогены, прогестерон, тестостерон)
• выработки желчных кислот
ЛИПОПРОТЕИНЫ – ЧТО ЭТО?
Кровь выполняет одну из важнейших функций в нашем организме – доставку различных питательных и регуляторных веществ во все уголки тела. И если доставка таких веществ как глюкоза, водорастворимые белки достаточна проста – они находятся в растворенном состоянии в плазме крови – то транспортировка жиров и жироподобных соединений (холестерина, холиновых эфиров, фосфоглицеридов и триацилглицерина) таким же образом невозможна, по причине практически полной их нерастворимости в виде. А между тем, они играют важную роль в нашем обмене веществ, поэтому их доставка осуществляется с помощью специальных белков-переносчиков. Они образуют с липидами особые комплексы – липопротеины, которые в виде дисперсионного раствора находятся в плазме крови во взвешенном состоянии и способны переноситься с током жидкости.
Липопротеины – это корабли, которые перевозят холестерин от печени в кровеносное русло и обратно. В данных комплексах может наблюдаться различное соотношение липидов и белков, что сильно влияет на плотность всего комплекса – чем больше в них жироподобных веществ, тем меньше плотность липопротеинов.
На основании плотности липопротеины можно разделить на:
• очень низкой плотности (ЛПОНП)
• низкой плотности (ЛПНП)
• средней плотности (ЛПСП)
• высокой плотности (ЛПВП)
Различная плотность липопротеинов связана с процентным содержанием жиров (остальное составляют протеины – белки). Жиры у ЛПОНП составляют около 90% всей массы, а у ЛПВП – 50%.
ЛПОНП – содержат в основном холестерин и триглицериды (нейтральные жиры) с небольшим количеством белков.
ЛПНП – также содержат холестерин, но кроме него транспортируют также фосфолипиды (основной компонент клеточных мембран всех клеток).
Наряду с ЛПОНП считается главным артрогенным фактором – данные липопротеины способны осаждаться и накапливаться на стенках сосудов, приводя к развитию атеросклероза. Поэтому при профилактике сердечно-сосудистых заболеваний всячески избегают повышения содержания этих компонентов липидного обмена.
ЛПСП – переносит холестерин, фосфолипиды и нейтральные жиры. Особого диагностического значения не имеют.
ЛПВП – транспортируют холестерин, имеют важное значение как противовес вредному влиянию других фракций липопротеинов.
Интерпретация анализа крови на содержание и структуру липопротеинов тесно связана с уровнем холестерина в крови. Это и не удивительно, ведь почти весь холестерин находится в составе различных липопротеинов. Из-за особенностей их строения и возникло понятие о «хорошем» и «плохом» холестерине – вещество, входящее в состав ЛПОНП и ЛПНП может считаться «плохим», так как именно эти компоненты липидного профиля крови принимают важное участие в развитии атеросклероза, тогда как холестерин из липопротеинов высокой плотности является «хорошим», поскольку не способствует изменению стенок кровеносных сосудов.
Холестерин же, входящий в состав всех фракций липопротеинов составляет такой биохимический показатель как Общий холестерин, норма которого – 3,5 – 7,5 ммоль/л. На основе этих данных была разработана формула, названная «коэффициент атерогенности», показывающая склонность человека к развитию атеросклероза:
«коэффициент атерогенности» = Общий холестерин – ЛПВП
Нормальное значение этого коэффициента не должно превышать 3, в противном случае риск развития сердечно-сосудистой патологии значительно увеличивается. Из этой же формулы следует, что при значительном увеличении фракции липопротеинов с низкой плотностью относительно высокой повышается вероятность развития атеросклероза.
ВИСЦЕРАЛЬНЫЙ ЖИР ХУЖЕ, ЧЕМ ПОДКОЖНЫЙ
В отличие от подкожного жира, висцеральный жир находится глубоко в тканях, обволакивая собою внутренние органы, особенно в брюшной полости:
• печень
• кишечник
• сердце
• почки
• поджелудочную железу
и даже проходит через мышцы
Висцеральный жир является самым опасным и может привести ко многим патологиям, в первую очередь сердечно-сосудистой системы. Опасность висцерального жира в том, что он сильно капиляризирован и соответственно выделяет достаточно много и постоянно жирные кислоты в кровь. Этот процесс достаточно негативен для здоровья человека.
Висцеральный жир притягивает в себя все токсичные химические вещества, попадающие в организм, после чего они попадают в кровоток. Этот процесс приводит к хроническому воспалению и нарушает метаболизм. Более того, висцеральный жир также может влиять на перепады настроения и общее самочувствие.
В отличие от подкожного жира, висцеральный жир мы не видим. Однако, эксперты Гарвардского университета отмечают, что люди с избыточным весом чаще всего, имеют и избыток висцерального жира, так как он составляет около десяти процентов от общего объема жира в организме.
Наличие возрастного животика подсказывает о наличии избытка висцерального жира, но диагностировать его по такому признаку нельзя, нужен более сложный анализ. Простых измерений, в том числе Индекс Массы тела (ИМТ) и индекс талия-бедро будет недостаточно, так как они могут указывать на любой тип жира.
Золотой стандарт обнаружения избыточного висцерального жира – это МРТ.
Причины накопления висцерального жира:
• высокое содержание простых углеводов в питании
• «любовь» к сахару
• «любовь» к алкоголю
• трансжиры
• дефицит белка
• стресс
• менопауза
• дефицит кишечных бактерий
• отсутствие физической активности
При этом стоит изменить принципы питания и начать питаться здоровой пищей и добавить регулярные ежедневные упражнения, снижение уровня этого скрытого врага вам гарантировано. Ограничение употребления алкоголя и управление над своими эмоциями, не допуская стрессовых ситуаций, также важно, как и хороший здоровый сон. Также следует отказаться от такой вредной привычки, как курение.
ЧТО ЗАСТАВЛЯЕТ ЖИР НАКАПЛИВАТЬСЯ В ТЕЛЕ ЧЕЛОВЕКА
Не все знают, что растительные жиры легче усваиваются и быстрее попадают в жировую клетку (адипоцит), чем жиры животного происхождения.
Если нам говорят, что главная опасность для нашего здоровья таиться в животных жирах, и что именно от них происходят все заболевания сосудов, то это несколько некорректно.
Дело в том, что в крови человека нет ни растительных жиров, ни животных жиров. В них есть только человеческий жир.
Жир, поступивший в желудочно-кишечный тракт, распадается на составные части, из которых уже синтезируется несколько другой — человеческий — жир. Как это происходит мы разбирали выше.
Человеческий жир имеет строго определенный состав жирных кислот, отличающий его от состава всех других жиров и масел. В человеческом жире в основном присутствуют следующие кислоты: насыщенные — миристиновая, пальмитиновая и стеариновая, ненасыщенные — пальмитоолеиновая, олеиновая и линолевая. При этом доля олеиновой кислоты 50%, миристиновой — 23%, линолевой — 10%, содержание остальных кислот от 3 до 6%. То есть ненасыщенных кислот в человеческом жире более 60%.
При этом, что для нас очень важно, в человеческом организме мононенасыщенная олеиновая кислота может образовываться путем дегидрирования насыщенной стеариновой, а мононенасыщенная пальмитоолеиновая может образовываться путем дегидрирования насыщенной пальмитиновой. В то время, как полиненасыщенные линолевая и линоленовая кислоты в организме не синтезируются и должны поступать с пищей.
Таким образом, несмотря на то, что человеческий жир состоит на 60% из ненасыщенных жирных кислот, подавляющая часть этих кислот получается в организме из насыщенных жирных кислот. И только ненасыщенные линолевая и линоленовая кислоты (всего их доля в человеческом жире примерно 15%) должны поступать из вне, преимущественно из растительных масел.
Доля линолевой и линоленовой кислот в растительных маслах обычно составляет 40% — 90%. Это значит, что при употреблении в пищу только растительных масел в организм человека будет поступать очень мало человеческого жира, так как в кишечнике образуется нехватка молекул насыщенных жирных кислот, комплектующих молекулы глицерина до молекулы человеческого жира. Солидная часть растительного масла в этом случае даже не попадает в кровь, она проходит по кишечнику и выходит вместе с калом.
Животные жиры более схожи по составу с человеческим жиром, поэтому животные жиры дают намного больший выход человеческого жира.
Ситуация кардинально меняется если животные и растительные жиры принимаются вместе (маргарин).
В этом случае часть растительных жиров, которая в обычном случае была бы транзитом выведена из организма, вовлекается в образование человеческого жира. Остававшиеся ранее неиспользованными насыщенные жирные кислоты теперь станут комплектоваться ненасыщенными жирными кислотами до молекул человеческого жира. То есть усиливается усвоение как растительных, так и животных жиров. Выход человеческого жира увеличивается примерно в два раза (М.Я. Жолондз, 1996). Жиров в лимфу, а затем и в кровь поступает в два раза больше. В два раза повышается опасность заболевания атеросклероза при той же калорийности питания.
Интересный факт, что если рассмотреть гормональные механизмы накопления жира в человеческом теле, то они отличаются у женщин и мужчин.
В женском теле за накопление жира в области бедер, ягодиц и молочных желез отвечают гормоны: эстроген и прогестерон. За накопление жира в области живота – инсулин. Таким образом, по локализации жира можно определить гормональную патологию.
В мужском теле, в норме, гормональный фон другой и наличие тестостерона, который кроме влияния на половую сферу, влияет на развитие костной и мышечной ткани, дает мужчинам некое преимущество. А поскольку именно в мышцах происходит сжигание жира во время физической нагрузки, то мужчинам легче сбрасывать вес и удерживать его.
ЦЕЛЛЮЛИТ
Относится к липодистрофии или жировой дистрофии — это патологическое состояние, характеризующееся зачастую патологией жировой ткани.
Встречается два основных вида липодистрофии: атрофия и гипертрофия.
Целлюлит – это термин косметологии. И представляет собой косметическую проблему внешнего вида кожи, изменения в которой обусловлены структурными изменениями подкожно-жировой клетчатки. Это состояние кожи не является заболеванием, не входит в международную классификацию болезней и не требует лечения. Внешне проявляется бугристостью кожи в виде «апельсиновой корки». Целлюлит редко встречается у мужчин. Среди мужчин он чаще встречается у мужчин с андроген-дефицитными состояниями.
Рыхлая, деформированная, неэластичная кожа в области бедер, ягодиц и живота беспокоит женщин не меньше, чем избыточная масса тела и ожирение. По данным многих авторов, эта проблема встречается у 80-90% женщин в разных странах. Наблюдается определенная закономерность в распространенности целлюлита. Статистика свидетельствует, что женщины азиатского и африканского происхождения менее склонны к развитию целлюлита, чем женщины белой расы. Возможно, это связано с национальными традициями в области питания и набором наиболее часто потребляемых продуктов. Многие авторы указывают на то, что наиболее остро проблема целлюлита стоит в тех странах, где употребляют в пищу большое количество насыщенных жиров. В Японии, где заболеваемость целлюлитом минимальна, население потребляет исключительно полиненасыщенные жиры и низкокалорийную пищу. Отмечено, что при изменении образа жизни и переходе на более калорийное питание распространенность целлюлита среди женщин негроидной и монголоидной рас увеличивается. Помимо характера питания существенное значение для формирования целлюлита имеет гиподинамия, которая во многих развитых странах является проблемой, требующей незамедлительного решения.

Не вызывает сомнений, что с точки зрения патогенеза целлюлит характеризуется триадой признаков:
• гипертрофией подкожной жировой клетчатки
• нарушениями микроциркуляции
• уплотнением соединительной ткани
Происходящие при этом изменения на клеточном и функциональном уровнях формируют порочный круг, ведущий к прогрессированию нарушений.
Изменения в жировой ткани
Иногда достаточно сложно разобраться, что же первично при формировании целлюлита: активация липогенеза или дисциркуляторные нарушения, настолько эти процессы взаимосвязаны. Ряд авторов выдвигает на первый план дегенерацию жировых клеток, которая приводит к фиброзу соединительной ткани. Они считают, что первичной при данной патологии является гипертрофия адипоцитов, изменяющая внутриклеточные процессы и нарушающая структуру мембран. Клетки все больше разбухают, соединительнотканные перегородки уплотняются, синтезируется все больше межклеточного вещества — в результате все сильнее затрудняется эвакуация жира из жировой вакуоли.
Жировая ткань как одна из систем организма, участвующих в патогенезе целлюлита, безусловно важна. Вещества, вырабатываемые адипоцитами, обладают разнообразным биологическим действием и могут влиять на активность метаболических процессов в тканях и различных системах организма либо напрямую, либо опосредованно, через нейроэндокринную систему, взаимодействуя с гормонами гипофиза, катехоламинами, инсулином. Увеличение объема адипоцитов происходит вследствие хронического нарушения их метаболизма, то есть нарушения баланса между липолизом и липогенезом.
Вместе с тем имеющиеся на сегодня данные, касающиеся патогенеза целлюлита, позволяют утверждать, что накопление жира в адипоцитах или, точнее, их гипертрофия, не является единственным патогенетическим фактором. Это подтверждается тем, что признаки целлюлита часто наблюдаются у женщин с нормальной и даже пониженной массой тела. Кроме того, известно, что при коррекции целлюлита, сопряженного с ожирением, снижение веса за счет уменьшения количества жировой ткани сопровождается визуальным ухудшением течения целлюлита. В процессе похудения перестраивается обмен веществ, меняются биохимические процессы, заставляя организм подстраиваться под вводимые изменения и ограничения, работать на пределе своих возможностей. И как следствие, подкожный жировой слой истончается, кожа начинает свисать неестественными складками. А истощение мышечных и соединительнотканных волокон приводит к появлению целлюлита.
Нарушение микроциркуляции
Состояние микроциркуляторного русла непосредственно связано с состоянием крупных сосудов. Практически все авторы подчеркивают: снижение мышечной активности и сидячий образ жизни ухудшают венозный отток, замедляют циркуляцию лимфы, что и приводит к снижению метаболизма, усилению липогенеза, и, как следствие, развитию целлюлита. Длительная сидячая работа и вождение автомобиля, характерные для многих активно работающих женщин, препятствуют нормальному кровотоку в нижних конечностях, вызывая венозный застой и повреждение капилляров.
Нарушение венозного оттока, застой лимфы ведут к повышению проницаемости сосудистой стенки и выходу плазмы в интерстициальное пространство. Возникающие при этом отек межуточной ткани и гипоксия усугубляют нарушения микроциркуляции, а выделяющиеся при повреждении эндотелия вещества способствуют пролиферации фибробластов и уплотнению соединительнотканных перегородок, которые уже не разграничивают, а сдавливают дольки жировой ткани.
Лимфатические капилляры, стенки которых образованы эндотелием, выводят из тканей избыток жидкости, белки и продукты обмена. Механизмы перемещения лимфы в капиллярах еще недостаточно ясны, однако доказано, что значительную роль играют сокращения крупных лимфатических сосудов (лимфангионов), имеющих развитую мышечную оболочку. Застой жидкости в просвете сосуда растягивает его стенку, нарушает поступательное продвижение лимфы, а отсутствие сокращений сосудов еще более усугубляет данный патогенетический механизм.
Основные параметры, характеризующие функционирование системы микроциркуляции, определяются состоянием гемодинамики в капиллярах, проницаемостью их стенок, силами, обеспечивающими движение интерстициальной жидкости и лимфы Нарушения микроциркуляции принято делить на сосудистые, внутрисосудистые и внесосудистые. Изменения кровотока, капиллярного давления, функционального состояния сосудистой стенки имеют значение для перфузии тканей (перфузия – метод подведения и пропускания крови, кровезамещающих растворов и биологически активных веществ через сосудистую систему органов и тканей организма.). Все нарушения микроциркуляции объединяет одно: в конечном итоге страдает транскапиллярный обмен. Изменения реологических свойств крови играют существенную роль в механизме повреждения тканей и тромбообразовании. На текучесть в системе микроциркуляции влияет и агрегационное состояние тромбоцитов. Ему отводится ведущая роль в тромбообразовании и развитии внутрисосудистой агрегации клеточных элементов.
Изменения в сосудистой стенке обусловлены изменениями местоположения и формы эндотелиальных клеток. Внесосудистые изменения, ведущие к нарушению микроциркуляции, связаны прежде всего с патологическими процессами в периваскулярной ткани. При снижении проницаемости стенок капилляров в первую очередь нарушается перенос биологически активных веществ через базальную мембрану. Изменения в биохимических процессах, водно-солевом обмене и характере окислительно-восстановительных реакций ведут к развитию циркуляторной гипоксии и ухудшению питания органов и тканей. При нарушении проницаемости капилляров существенно страдают пластический обмен и энергетическое обеспечение клеток. Микроциркуляторные нарушения приводят к снижению потребления кислорода и аэробной производительности. Все перечисленное в конечном итоге приводит и к нарушениям в системе «липолиз-липогенез».
Текучесть крови в сосудах зависит от состава плазмы, характера кровотока в микрососудах (турбулентный или ламинарный), пластичности и деформируемости эритроцитов, склонности клеток к агрегации. Известно, что гиперлипидемия влияет на состояние стенок сосудов, свертываемость крови, микроциркуляцию и перфузию органов. Текучесть крови в микрососудах во многом определяется белковолипидным составом плазмы. При высокой концентрации липопротеинов в плазме кровоток в сосудах малого диаметра становится прерывистым, турбулентным. При гиперлипидемии возрастает содержание холестерина в мембранах эритроцитов, увеличивается их размер, они становятся менее пластичными, ухудшается их способность менять свою форму при прохождении через капилляры, возрастает вязкость крови, увеличивается агрегация эритроцитов. Изучение микроциркуляции у лиц с гиперлипидемией выявило как функциональные нарушения капиллярного кровотока (замедление тока крови, его «зернистость», образование микроагрегатов, застой крови, микротромбозы), так и морфологические изменения самих капилляров (скрученность, неравномерность диаметра, микроаневризмы, запустевание с выключением тока крови).
Гиперлипидемия сопровождается уменьшением артериовенозной разницы по кислороду и свидетельствует об ухудшении утилизации кислорода в периферических тканях. При гиперлипидемии нарушается способность эндотелия вырабатывать эндотелиальный фактор расслабления сосудов — окись азота. Кроме того, гипоксия, которую испытывают клетки эндотелия в условиях гиперлипидемии, ведет к усиленной продукции эндотелина, сильного вазоконстриктора и антагониста окиси азота, что в итоге приводит к нарушению микроциркуляции.
По-видимому, на начальных стадиях развития целлюлита происходят снижение тонуса артериол, значительное повышение внутрисосудистого сопротивления, развивается незначительный венозный застой, застой в капиллярном звене микроциркуляции; пассивные механизмы регуляции микроциркуляции преобладают над активными. Кровенаполнение капилляров на начальных стадиях, с одной стороны, обеспечивает адекватную трофику тканей, а с другой стороны, переполнение капиллярного русла запускает патогенетические механизмы развития целлюлита (расширение капилляров, транссудация плазмы в окружающие ткани, развитие отека, задержка жидкости в тканях, сдавливание окружающих тканей). При прогрессировании целлюлита формируется спастический тип микроциркуляции, характеризующийся повышением тонуса артериол, ростом внутрисосудистого сопротивления, более выраженным венозным застоем, преобладанием активных механизмов регуляции кровотока, существенным снижением базального кровотока, недостаточным кровенаполнением в капиллярном звене. Недостаток кровенаполнения в капиллярном звене может приводить к гипоксии, активации фибробластов и развитию фибросклероза, что характерно для третьей и четвертой стадий целлюлита. Более выраженные явления венозного застоя, чем у пациентов с атоническим типом, свидетельствуют о значительных нарушениях и декомпенсации венулярного звена микроциркуляции.
Изменения в соединительной ткани
Третий фактор, участвующий в патогенезе целлюлита, — соединительная ткань.
Молекула коллагена – основного белка кожи – состоит из двух тысяч аминокислот. Коллаген отвечает за прочность и эластичность кожи. Если нарушается синтез такого сложнейшего белка, не помогут самые дорогие и современные кремы.
После того, как человек не слишком успешно экспериментирует с разнообразными диетами, подкожный жир начинает откладываться не ровным слоем, а в виде комочков или даже целых гроздьев, слабо соединенных между собой. Удерживать или связывать эти жировые отложения должны были бы те самые коллагеновые волокна соединительной ткани, безвозвратно утерянные в результате многочисленных голодовок. Если этот природный каркас разрушен, тогда существует большая вероятность появления «апельсиновой корочки».
У женщин от природы синтез белков всегда уступает по интенсивности росту жиров. И когда женщины начинают увлекаться низкокалорийными диетами (голоданием, хоть и лечебным), то этот разрыв – между распадом белков и их синтезом – становится огромным. И тогда и появляется целлюлит.
Гормональный дисбаланс
Усугублению микроциркуляторных нарушений способствует гормональный дисбаланс: снижение уровня прогестерона, повышение эстрогена.
Чем больше эстрогена в организме, тем больше нарушается обмен веществ и тем выше вероятность образования целлюлита. Поскольку эстроген способен активно влиять на жировую ткань, он вызывает разрастание этой неравномерной жировой прослойки в самых проблемных местах, одновременно задерживая воду в тканях. В определенный период жизни его роль является определяющей, при этом большинство эстрогенов синтезируется в жировой ткани.
Заключение
Исходя из описанных механизмов формирования целлюлита, любые мероприятия, направленные на его коррекцию, должны учитывать как характер нарушений микроциркуляции, выраженность жировых отложений и изменений в соединительной ткани, так и стадию процесса. Очевидно, что массаж, бальнеотерапия, талассотерапия, фитотерапия, пищевые добавки, разнообразные обертывания, укутывания и заматывания возможно приведут к некоторому улучшению состояния, но не будут решением проблемы. Если говорить о кремах, гелях, мезотерапии, лимфодренаже и подобных вещах, то опять же, наверное хуже не будет… вопрос насколько все же результативность стоит своих денег?
Мое решение – это движение и питание! Помните, что физическая нагрузка и силовая, и аэробная очень важна, в том числе, и при желании избавиться от целлюлита. Можно использовать контрастный душ и жесткую мочалку для улучшения кровообращения. Ванна с морской солью выводит из кожи токсины и увеличивает ее тонус. Делайте пилинг со скрабами для отшелушивания старых клеток кожи и стимулирования роста нового, более молодого, а значит и более эластичного эпидермиса. Немаловажное и положительное воздействие на кожу оказывают Q10 и масло абрикосовой косточки.
Каждый день организму нужно достаточное количество белка, для того чтобы восстанавливать и строить мышечную и соединительную ткани. Необходимы ненасыщенные жиры для поддержания упругости и эластичности кожи.
И терпение, поскольку в данном случае, чем медленнее, тем больше вероятности, что тело будет успевать перестраиваться под то, что мы от него требуем.
ИНСУЛИНО-РЕЗИСТЕНТНОСТЬ
Инсулинорезистентность представляет собой нарушение метаболического ответа на эндогенный или экзогенный инсулин. Данное состояние приводит к повышенной концентрации инсулина в плазме крови по сравнению с физиологическими значениями для имеющейся концентрации глюкозы. Данное понятие применимо ко всем физиологическим эффектам инсулина, его влиянию на белковый, жировой обмен, состояние эндотелия сосудов. Резистентность может развиться как к одному из эффектов инсулина независимо от других, так и комплексно.
Инсулинорезистентность – это нечувствительность клеток к инсулину, невозможность для клеток, образно говоря, взять глюкозу для использования. В результате поджелудочная железа производит ещё больше инсулина, чтобы помочь глюкозе попасть в клетку. И пока она в состоянии производить достаточно инсулина, ваш уровень сахара будет оставаться в норме.
Именно поэтому у лиц с инсулинорезистентностью уровень сахара может оставаться в норме длительное время.
Инсулинорезистентность является фактором риска для множества заболеваний и состояний, таких как:
• метаболический синдром
• ожирение печени
• диабет 2 типа
• атеросклероз
• гипертензия
• поликистоз яичников
Высокий уровень инсулина усиливает аппетит, что приводит дополнительному потреблению углеводов и увеличению веса. Прекратить этот порочный круг нужно как можно раньше, прежде чем разовьются сложные заболевания и осложнения.
Что нужно делать, чтобы изменить резистентность к инсулину:
• изменение привычек питания
• изменение образа жизни
• выполнение физических упражнений
• грамотное медикаментозное лечение
Новости | О нас | Статьи | Асана | Магазин | Библиотека | Рецепты | Фитотерапия | Главная Карта Сайта